CARTISTEM® es un medicamento de células madre alogénicas adultas preparado a partir de reservas frescas crio-preservadas, el cual contiene Células Madre Mesenquimatosas Humanas (hUCB-MSCs). CARTISTEM® está recomendado para el tratamiento de defectos de cartílago articular de rodilla (ICRS grado IV) en pacientes con osteoartritis resultante de enfermedad degenerativa o traumas recurrentes.
CARTISTEM® es elaborado en Corea del Sur a partir de células madre aisladas de la sangre del cordón umbilical de recién nacidos saludables, donado por sus padres. Tanto la sangre del cordón umbilical del recién nacido como la sangre de la madre son examinadas para descartar cualquier enfermedad contagiosa, previo al aislamiento y procesamiento de las células madre.
La sangre de cordón umbilical (UCB) es una fuente original de células madre adultas eficaces, que son consideradas las de menor conflicto ético ya que la sangre de cordón umbilical se califica como tejido residual. Por lo tanto, el uso de células madre UCB está respaldado por distintos grupos religiosos incluyendo la Iglesia Católica.
El sencillo y efectivo procedimiento quirúrgico CARTISTEM® que se realiza en el Hospital St. Mary en Corea del Sur, implica la aplicación instantánea del Medicamento Terapéutico de Células Madre, sin necesidad de realizar una recolección invasiva de tejidos propios del paciente.
CARTISTEM® es fabricado en Corea del Sur bajo estrictos estándares calidad controlados por las agencias reguladoras, lo que asegura que se entregue a los pacientes un Medicamento Terapéutico de Células Madre seguro y consistentemente eficaz. Desde 2012 se han aplicado miles de dosis del medicamento CARTISTEM® sin haberse presentado ningún problema de seguridad o efectos secundarios. El medicamento puede ser aplicado a cualquier paciente independientemente de su tipo de sangre, edad, sexo o etnia. Cada vial de CARTISTEM® contiene 7,5 millones de células madre cuya potencia terapéutica ha sido debidamente verificada, y toma aproximadamente 6 meses en su elaboración.
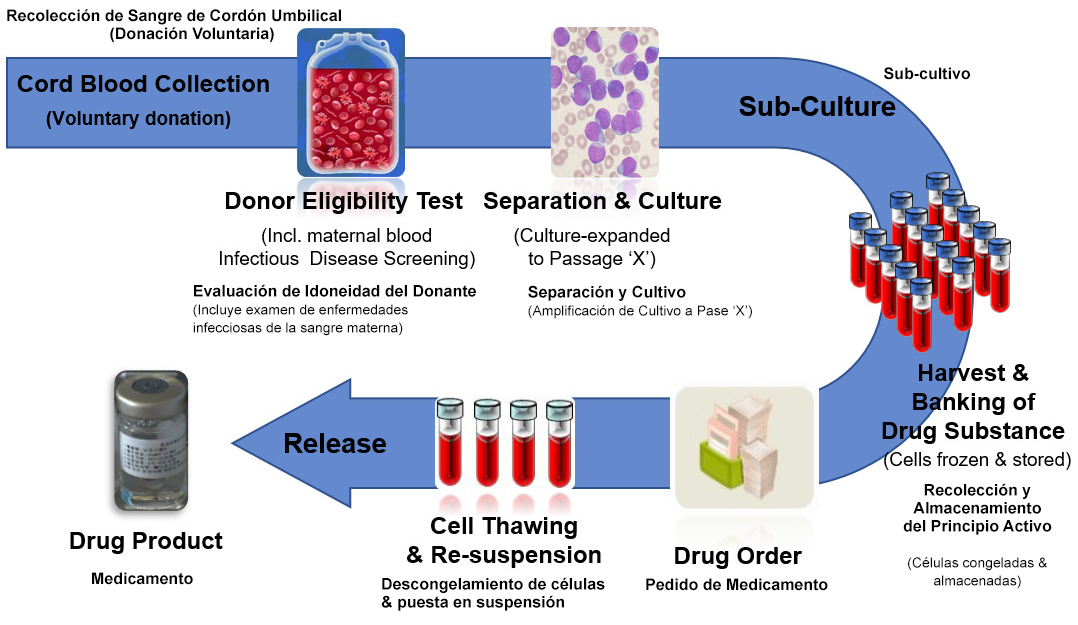
Más de 12 años de investigación y pruebas clínicas han demostrado la seguridad y eficacia de CARTISTEM®. Sus bases científicas han sido documentadas en las publicaciones médicas más prestigiosas del mundo.
Haga Click para acceder a publicaciones sobre CARTISTEM®.
Haga Click para acceder a las Pruebas Clínicas.
Haga Click para acceder a otras opciones de tratamientos existentes para osteoartritis de rodilla.
Los peligros de las afirmaciones no demostradas sobre los medicamentos de células madre.
En los Estados Unidos existen alrededor de 570 clínicas de células madre que permanentemente hacen afirmaciones no probadas sobre sus tratamientos para diversas enfermedades. La realidad es que la FDA de Estados Unidos no ha aprobado ningún medicamento de células madre hasta la fecha. Estos tratamientos no tienen evidencia de pruebas clínicas y no se ha demostrado que sean seguros para los pacientes. Típicamente en estas clínicas los tratamientos consisten en extraer células madre propias del paciente, centrifugarlas, procesarlas y ponerlas de vuelta en el paciente. Este proceso toma aproximadamente 3 horas, y si el paciente tiene 60 años de edad por ejemplo, las células madre tendrán 60 años de edad también. Estas clínicas no están autorizadas técnicamente por la FDA para manipular las células madre de los pacientes, sin embargo dicha manipulación sucede frecuentemente, lo cual es una práctica que no garantiza ninguna mejora clínica del paciente y que incluso puede ser peligrosa.
Haga Click para ver cómo la FDA está combatiendo las clínicas de células madre.
El tratamiento CARTISTEM®: comprobado y seguro.
Durante los últimos cinco años, miles de pacientes en Corea del Sur han recibido el tratamiento CARTISTEM® de forma exitosa, sin haber existido un solo caso reportado de reacciones adversas. Los pacientes participantes en la Prueba Aleatoria Controlada Fase 3 tenían entre 50 y 70 años de edad con historias de cartílago de rodilla degenerativo. Todas las pruebas clínicas fueron aprobadas y confirmadas por el MFDS (Ministerio para la Seguridad de Drogas y Alimentos), conocido anteriormente como el FDA de Corea del Sur. La autorización para la venta comercial de CARTISTEM® fue otorgada por el MFDS en enero del 2012.
La prueba de la regeneración de cartílago por medio del tratamiento CARTISTEM® consistió en una evaluación artroscópica de la rodilla del paciente a las 48 semanas de la cirugía. Dicha evaluación artroscópica demostró que el cartílago se había regenerado como cartílago propio natural del paciente. Los resultados de las Pruebas Fase 3 (incluyendo una evaluación a los 5 años) aparecerán en una publicación médica importante en el año 2018.
CARTISTEM® ha completado también la Fase 1/2a de pruebas clínicas de la US-FDA Investigational New Drug (Nuevo Medicamento Experimental) en el Centro Médico de la Universidad RUSH, en Chicago, Illinois, y en el Brigham and Women´s Hospital de Chestnut Hill, Massachussets. CARTISTEM® pasó también las normas de seguridad y efectividad en las pruebas clínicas en Estados Unidos.
El MFDS (FDA de Corea del Sur) audita regularmente las instalaciones de fabricación GMP (Good Manufacturing Process – Buenas Prácticas de Fabricación) del Medicamento Terapéutico de Células de MEDIPOST, ubicado en Seúl. Cada vial de CARTISTEM® es examinado por MEDIPOST durante varias etapas para confirmar su seguridad y eficacia antes de ser entregado.
CARTISTEM® es el único Medicamento Terapéutico de Células Madre aprobado en el mundo para la regeneración de cartílago de rodilla.
La etiqueta de aprobación del producto de la Autoridad Reguladora de Corea del Sur (MFDS) para CARTISTEM® dice lo siguiente: los esfuerzos conjuntos de MEDIPOST y del Centro Médico Samsung han dado como resultado el desarrollo exitoso de CARTISTEM®, Medicamento Terapéutico de Células Madre Alogénicas derivadas de Sangre de Cordón Umbilical (UCB), aprobado por la autoridad reguladora de Corea del Sur. Por medio de una rigurosa investigación y desarrollo desde el año 2001, se comprobó que CARTISTEM® regeneró el cartílago de rodilla en el 98% de los pacientes que participaron en las pruebas clínicas aleatorias controladas Fase 3.
“CARTISTEM® se recomienda para el tratamiento de defectos de cartílago articular en pacientes con osteoartritis (ICRS grado IV) causada por enfermedad degenerativa o trauma recurrente.”
Existen unos pocos países en el mundo que cuentan con leyes para regular y aprobar medicamentos terapéuticos de células madre, siendo Corea del Sur el país líder en este campo. En Corea del Sur CARTISTEM® ha pasado por rigurosas series de estudios pre-clínicos (animales) y pruebas clínicas controladas, y ha sido utilizado comercialmente de forma exitosa para tratar a miles de pacientes hasta la fecha.
Acerca de Zemyna
Zemyna se ha asociado con MEDIPOST para distribuir CARTISTEM® en otros países donde obtiene su aprobación y registro sanitario. Zemyna ha coordinado además con MEDIPOST el tratamiento con CARTISTEM® para pacientes extranjeros en Corea del Sur. Zemyna tiene adicionalmente el acuerdo con el Hospital St. Mary en Incheon-Seúl para proporcionar el tratamiento CARTISTEM® a pacientes de todo el mundo.
Contacte a Zemyna: [email protected]
